
Back مخلقة الغلوتامين Arabic Glutamat-Ammonium-Ligase German Glutamine synthetase English گلوتامین سنتتاز Persian Glutamiinisyntetaasi Finnish Glutamine synthétase French Glutamina sintetase Galician Glutamin szintetáz Hungarian Glutamin sintetase ID Glutammina sintetasi Italian
| Glutamato-amonio ligasa | ||||
|---|---|---|---|---|
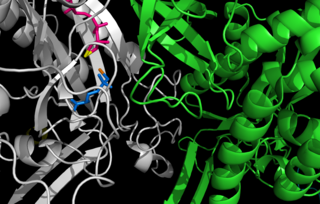 Centro activo entre dos monómeros de glutamina sintetasa de la Salmonella typhimurium. Los sitios de unión de los cationes están en amarillo y naranja, el ADP está en rosa y la fosfinotricina está en azul.[1] | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 6.3.1.2 | |||
| Número CAS | 9023-70-5 | |||
| Ortólogos | ||||
| Especies |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
| Glutamina sintetasa, dominio beta-Grasp | ||
|---|---|---|
| Identificadores | ||
| Símbolo | Gln-synt_N | |
| Pfam | PF03951 | |
| InterPro | IPR008147 | |
| PROSITE | PDOC00162 | |
| SCOP | 2gls | |
| Glutamina sintetasa, dominio catabólico | ||
|---|---|---|
 12 subunidades enzimáticas de la glutamina sintetasa de la Salmonella typhimurium.[2] | ||
| Identificadores | ||
| Símbolo | Gln-synt_C | |
| Pfam | PF00120 | |
| InterPro | IPR008146 | |
| PROSITE | PDOC00162 | |
| SCOP | 2gls | |
| Glutamato-amonio ligasa (Glutamina sintetasa) | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB |
Lista de códigos PDB 2qc8
| |||
| Identificadores | ||||
| Símbolos | GLUL (HGNC: 4341) GLNS | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 6.3.1.2 | |||
| Locus | Cr. 1 q31 | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
La glutamina sintetasa(GS) (EC 6.3.1.2)[3] es una enzima que tiene un papel esencial en el metabolismo del nitrógeno, catalizando la condensación del glutamato y el amoníaco para formar glutamina:
Glutamato + ATP + NH3 → Glutamina + ADP + fosfato


La glutamina sintetasa utiliza amoníaco producido por la reducción del nitrato, la degradación de aminoácidos y la fosforilación.[4] El grupo amino del glutamato es una fuente de nitrógeno para la síntesis de metabolitos provisionales de glutamina.[5]
También puede haber otro tipo de reacciones vía GS. La formación e hidrólisis del glutamato se ven influidas por la competición entre los iones de amonio y el agua, su afinidad y la concentración de iones de amonio. Se forma la glutamina si un ion de amonio ataca un intermediario de acetil-fosfato, mientras que el glutamato se rehace si el agua ataca el intermediario.[6][7] Los iones de amonio crean uniones más fuertes con la GS que el agua por las cargas electroestáticas entre un catión y un bolsillo cargado negativamente.[4] Otra posible reacción es que el NH2OH se una a la GS en lugar del NH4+ y ceda γ-glutamilhidroxamato.[6][7]
- ↑ PDB 1FPY
- Gill HS, Eisenberg D (febrero de 2001). «The crystal structure of phosphinothricin in the active site of glutamine synthetase illuminates the mechanism of enzymatic inhibition». Biochemistry 40 (7): 1903-12. PMID 11329256. doi:10.1021/bi002438h.
- ↑ PDB 2GLS
- ↑ "Eisenberg D, Almassy RJ, Janson CA, Chapman MS, Suh SW, Cascio D, Smith WW (1987). "Some evolutionary relationships of the primary biological catalysts glutamine synthetase and RuBisCO".Cold Spring Harb. Symp. Quant. Biol. 52: 483–90. PMID2900091
- ↑ a b "Liaw SH, Kuo I, Eisenberg D (Nov 1995)." "Discovery of the ammonium substrate site on glutamine synthetase, a third cation binding site". Protein Sci. 4 (11): 2358–65 doi:10.1002/pro.5560041114. PMC 2143006. PMID 8563633.
- ↑ "Liaw SH, Pan C, Eisenberg D (Jun 1993)". "Feedback inhibition of fully unadenylylated glutamine synthetase from Salmonella typhimurium by glycine, alanine, and serine". Proc. Natl. Acad. Sci. USA 90 (11):4996–5000. doi:10.1073/pnas.90.11.4996. PMC 46640. PMID 8099447.
- ↑ a b "Eisenberg D, Gill HS, Pfluegl GM, Rotstein SH (Mar 2000). "Structure-function relationships of glutamine synthetases". Biochim Biophys Acta. 1477(1-2):122–45. doi:10.1016/S0167-4838(99)00270-8. PMID10708854.
- ↑ a b Liaw SH, Eisenberg D (Jan 1994). "Structural model for the reaction mechanism of glutamine synthetase, based on five crystal structures of enzyme-substrate complexes". Biochemistry 33 (3):675–81. doi:10.1021/bi00169a007.. PMID 7904828.
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search